シリーズ 超極小『素粒子』の世界21 ~物質の性質の違いはどうして生まれるの?
結合シリーズの前回の投稿では、全ての物質は各原子や分子同士が電荷引力で結合していることによって成り立っていることを明らかにしましたリンク。
ところで、物質の素材は元素です。この元素(原子)はどの元素も原子核と電子から成り立っており、そして原子核は陽子と中性子から成り立っています。つまり素材は全て一緒です。現在自然界の元素は92種類(人工元素も含めれば118種類)ありますが、この素材である陽子と電子(と中性子)の数だけで多種多様な元素の性質が決定されているということになります。
考えてみればとても不思議なことと思いませんか? 🙄
では、具体的に地球上(宇宙でも)で多数存在する元素であり、生体物質を構成する中心的な元素でもある、炭素、窒素、酸素を例にとって比較して見ましょう。
【炭素・窒素・酸素はなぜこんなに違う?】
炭素(C) 常温では固体で非常に安定しており、化学反応を起こしません(炭素は天然では石炭や黒鉛やダイヤモンド、また炭酸塩や有機化合物として存在します)。
窒素(N2) 常温では気体で、化学反応をあまり起こせません(天然では大気中の窒素、アミノ酸、タンパク質などの生体物質として存在します)。
酸素(O2) 常温では気体で、さまざまな元素と活発に反応します。特に水素、リン、一部の金属とは爆発的に反応し光や熱の発生を伴う反応=燃焼を発生させます。(天然では空気中のほか酸化物として地殻中に存在します)
炭素、窒素、酸素は周期表ではそれぞれ隣同士です。つまり陽子と電子(と中性子)の数がそれぞれたった一つ違うだけです。(厳密に言えばそれぞれ同位体=陽子・電子の数が同じで、中性子の数だけが多いものがありますが化学的性質は殆ど変わりません)
【違いの秘密は価電子の数にある】
では電子や陽子のたった一つの違いがなぜ物性の大きな違いを呼ぶのでしょうか?
実は秘密は価電子(原子の最も外側にある電子)の数の違いにあります。
価電子は8つで最も安定するという性質を持っています。つまり、それぞれの元素は価電子の数が8つになるように、電子を他の原子から奪って=相手の原子と共有して(もしくは放り出して)安定状態を作り出そうとします。これが化学反応です。
炭素は電子が6つ、窒素は7つ、酸素は8つです。そしてそれぞれの電子2つはまずエネルギー準位の低い最も内側の軌道(S軌道)に入り込むので、価電子はそれぞれ、4つ、5つ、6つということになります。
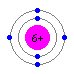
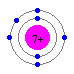
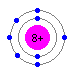
炭素(C) 窒素(N) 酸素(O)
つまり8つの安定数まで、各々炭素は4つ、窒素は3つ、酸素は足りないのは2つだけです。この足りない電子を補うためには同じく電子が不足している相手方の原子が必要となりますが、二つであれば比較的相手方を見つけやすく、3つだとやや見つけにくくなり、4つだとさらに見つけにくくなります。相手を見つける=化学反応を起こすためには、原子や分子の高スピードでの衝突が必要です。つまり、炭素や窒素が化学反応を起こすためには常温より高温高圧の状態=原子・分子の運動エネルギーが活発で原子や分子が頻繁に高速で衝突する状態、が必要となるというわけです。
炭素、窒素、酸素の常温における化学反応の起こりやすさは、このように価電子の数によってその違いが説明できます。
陽子や中性子の数はその元素の内包する結合エネルギーを表し、元素の化学的性質は価電子が規定しているのです。因みに酸素に陽子・電子がさらに一個加わった(周期表の隣)はフッ素(F2)で、1つ電子が足りないだけですから、常温で他の元素とより容易に、激しく反応します。
さらに一つ増えたものがネオン(Ne)で、これは価電子がちょうど8つですから、極めて安定した状態で、殆ど他の物質と(高温高圧でも)化学反応しません。価電子が8つの原子は希ガスと呼ばれ(Ar.Krなど)他の元素と基本的に反応しません。
つまり物質は、希ガスのように安定状態を目指して結合を起こすのです。
【炭素分子が固体であるのはなんで?-立体構造をを生み出す炭素の秘密-】
さて、では、常温で炭素が固体、窒素、酸素が気体であるのはなぜでしょう。
炭素は4つの電子を欲しています。この4つの電子を炭素同士が補い合っている(共有している)のが、炭素分子です。つまり炭素は4方向(上下左右の3次元に)に結合することが可能な元素です。このため炭素同士が結合すれば立体構造を持った、大きな結晶となり分子量は巨大なものとなります(下図)。
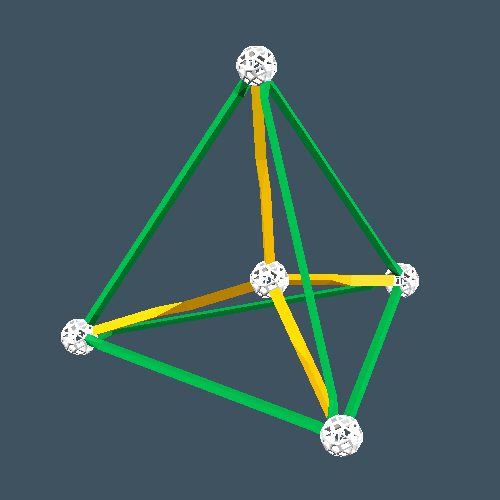
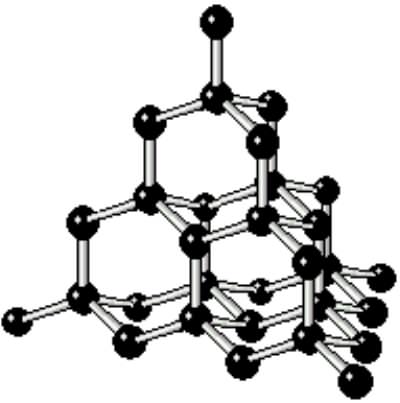
炭素原子(5個)の立体構造 ダイヤモンドの立体構造
因み
にこの炭素の4方に結合する性質はタンパク質や炭水化物等の巨大分子を形成する基礎でもあります。
それに対して窒素分子や酸素分子は、このような結合構造をもたず、窒素分子や酸素分子を作る場合は相方の窒素原子や酸素原子と3重結合(3組の価電子を共有)、2重結合(2組を共有)を行なうことで自己完結型の窒素原子(N≡N)、酸素原子(O=O)を形成しており、炭素の様に大きな分子を作りません。もちろんフッ素も共有できる電子は一つだけなので大きな分子は作れません。
分子が固体であるか気体(液体)であるかは、分子同士が結合しようとする力に規定されます。つまり分子間引力(ファンデルワールス力)に規定されます。ファンデルワールス力の正体は電荷引力であることは前回明らかにしました。
つまりファンデルワールス力は一つの分子が内包する電荷力つまり陽子(電子)の数に規定されます)。陽子の数が少なく、かつ大きな分子を作らない窒素や酸素が、分子間引力が弱く、気体であるのはそのためです。
【価電子数が同じ元素は性格が良く似ている】
ところで今までの説明でもあるように、価電子数が同じ元素は似た性質を持つという特徴を持っています。例えば酸素と硫黄(S2)は価電子数が同じ6つです。この二つの化学的性質は似ており、火山の近くでは酸素の代わりに硫黄を呼吸で使っている生物も存在します。また、窒素と同じ5つのものにはリンや砒素があります。ATP(アデノシン3リン酸)生体内のエネルギーのやり取りを媒介するリン(P)の代わりに砒素(As)を用いる生物もいることは、このブログでも扱いましたね。また4つのものにはケイ素(Si)やゲルマニウム(Ge)があり、炭素と同じく巨大な結晶を作ります。


ケイ素の結晶 ゲルマニウムの結晶
だから炭素を骨格とするアミノ酸の代わりに珪素を使う生き物が宇宙のどこかにいる可能性があることは否定できません。仮にそれは存在しないにしても、ケイ素の結晶であるシリコンや、ゲルマニウムが、集積回路(IC)や人工知能の主役でもあることは興味深いことです。
いずれにせよ、化学反は、突き詰めれば電子のやり取りであり、物質のいろんな性質が価電子数(電子の振る舞い)で説明できることは、ちょっとした気付きで面白いですね 😉
トラックバック
このエントリーのトラックバックURL:
http://www.seibutsushi.net/blog/2012/08/1317.html/trackback

いいね