シリーズ 超極小『素粒子』の世界17 ~物質ってどうやってできてるの(1)-化学結合の仕組み-
皆さんは物質さらには人体がどのように作られているか知っていますか? 😀
あらゆる物質は、原子と原子あるいは分子と分子が化学結合することによって成立しています。
原子の結合は大きくは共有結合とイオン結合などに大別されていますが、さらに分子と分子が分子間力であるファンデルワールス力によって結びつくことで、諸物質が構成されています。
さらに生命にとって不可欠な核酸やタンパク質の次元では、水素結合やジスフィルド結合などの結合様式によって複雑な立体構造を作り上げています。
この「結合シリーズ」ではこのような物質(分子)の在り様をそのもっとも基礎となる「結合」(と化学反応=組み替え再結合)の観点から解き明かし、最終的には生体内高分子の特色(巨大分子でありかつ化学反応しやすい)の秘密に迫って行きたいと考えています 😀
他方、当ブログでは電磁波や素粒子についてシリーズで扱っていきますが、そのミクロの世界との接点(共通点)についても探って行きたいと考えています。
欲張りなシリーズですが皆さんお楽しみに 
<化学結合の分類 イオン結合・共有結合・金属結合>
まずは一般的な化学の教科書から(高校参考書から)の引用です。
物質はいくつかの原子やイオンなどの粒子が結びついて出来ています。このような、原子やイオンなどの結びつきを化学結合と呼んでいます。そして化学の教科書では原子の結合の分類として次の3種類を上げています。
①イオン結合 陽イオンと陰イオンの結合
例えば塩化ナトリウムはNaClはナトリウムイオンNa+と塩化物イオンCl-が引き合って出来ています。つまり陽イオンと陰イオンの電気的引力によって結合しています。これをイオン結合と呼んでいます。食塩、塩酸などの水溶液や液体は電気を通します。
②共有結合 主に非金属の原子間の結合
例えば水素分子H2は2つの水素原子の最外殻の電子の軌道が互いに重なり合うことによって結合しています(という表現になっています)。つまり両方の原子によって、両方の価電子(原子核から見て最も外側の軌道を持つ電子)が共有されて出来る結合を共有結合と呼んでいます。固体ではダイヤモンドや水晶等もそうです。
③金属結合 金属元素の原子間の結合
金属元素の価電子は元の原子から離れやすく(イオン化しやすく)、特定の原子に固定されずに金属内を自由に移動することができます。このような電子を自由電子と呼びますが、金属ではこの自由電子が全ての原子によって共有されていると考えることが出来ます。このような化学結合を金属結合と呼びます。鉄、アルミ、金など殆どの金属がそうです。
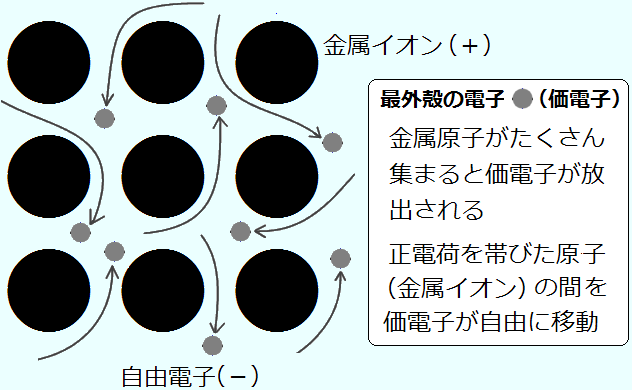
<3つの結合の関係はどうなってるの>
これだけの説明だと、これらの3つの結合は一見全くの別物に見えますね。
しかし、まず金属結合は、価電子が全ての電子に共有されているという状態であり、その意味では共有結合の特殊形です。つまり共有結合の一種です。
ではイオン結合と共有結合との関係はどのようになっているのでしょうか。
イオン結合の電気的引力は、陰イオンが受け取った価電子の電荷(マイナス)と電子を放出した陽イオンの原子核の陽子のプラスの電荷引力が生み出しているものです。
それでは共有結合は引力という観点ではどのような力によって結びついているのでしょうか
下の図を見てください。二つの水素原子が結合する様子です。
2つの水素原子が近づいたときは、2つの原子核2つの電子の間には斥力(反発力)が働き
原子核と電子の間には引力が働きます。2つの水素原子が近づきすぎると斥力が強く働いてエネルギーの高い状態になり、不安定となるが原子核距離が0.074nmのときはエネルギーがもっとも低くなり安定となります。この状態を結合してると呼ぶのです。
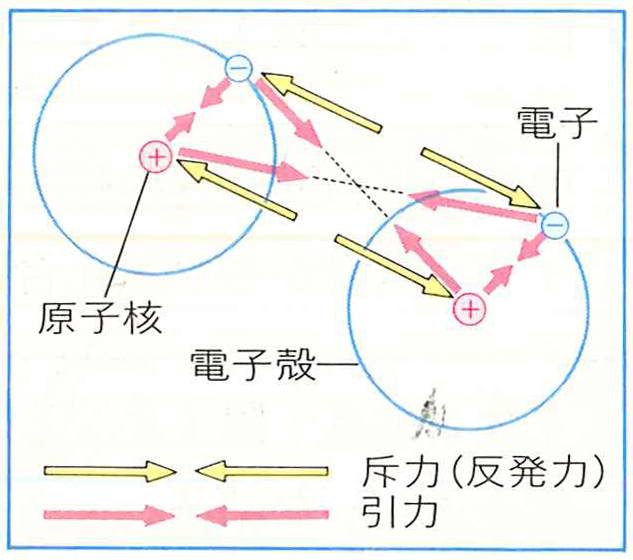
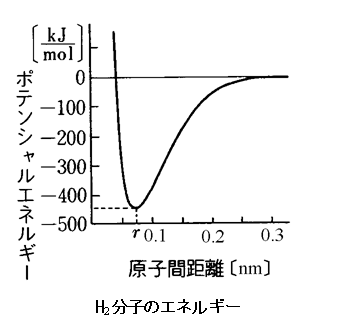
だとすればこれは正確には電子が軌道を共有しているとは言えません。電気引力と斥力のバランスの取れた状態に原子核と電子がある状態にあるに過ぎません。
実は化学の教科書は結構誤解を生む表現が多いのです。
そして何より重要なことは、イオン結合も共有結合も金属結合も、結局価電子と陽子との間の電荷引力によって結合しているということなのです。
その意味ではこの3種の別の表現で表された結合の様式は、本質的には電荷引力による結合と統一的に説明が可能なのです。違いはイオンは片方の原子が他の原子に電子を放り出しているのに対し(共有されていない)、共有結合は原子内に(概ね)共有されているという違いに過ぎません。
<分子の結合も電荷引力>
原子間の結合だけではありません。実は分子間の結合(ファンデルワールス力)でも同じです。
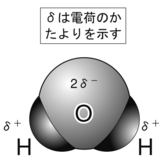
分子間の結合の一つであり、DNAの螺旋構造を形成するのに重要な働きをしている水素結合を例に取って説明しましょう。水分子H2Oにおいては電気陰性度(電子の引きつけやすさ)の違いによって、O原子のほうに電子が引き寄せられています(この状態を極性があると呼びます)。このことからH原子は他の分子中の電気陰性度の高い原子(核)に引き付けられやすくなます。つまりH原子が他の原子と結合しやすくなります。これを水素結合と呼びます。共有結合やイオン結合よりは弱いですが、分子間の結合の中ではかなり強い結合です。
また極性がない場合の分子間引力(H2、CH4など)も一つの分子内の原子の核外電子(-)が、隣の分子内の原子核(+)と引き合うことで固体や液体を形成します。
今の表現でお分かりのように、これらも原子の電荷引力による結合です。
では本質的に同じものであるこれらの結合様式は何故わざわざ分類されているのでしょうか
化学者たちがこの分類を教科書的に振り分けているのは、例えばイオン結合は、化学反応を起こしやすく、共有結合はそれに比べて起こしにくいものが多いからなのです。化学者の問題意識が化学反応の起こしやすさにあるからなんですね。
高校化学で学習したはずのさまざまな結合は全く別物であると私も含めて誤解していた人が多かったのではないかと思います。結合の引力という観点で見れば、本質的に全て電荷引力であることはちょっとした発見で面白いですね。
しかも量子力学の不確定性原理によれば、実は各原子の価電子はどこにあるか分かりません。瞬間瞬間でその位置(原子核との距離)は変動し続けているのです。その意味では実は結合といっても瞬間瞬間では分離していたり、共有結合的(電子が共有状態にある)になったりイオン結合的(電子が片方の原子からから離れた状態にある)になったりしているともいえるのです。そうすると益々この結合の区分というのは怪しくなってきますね。
この分子が実は常に生々流転していることも今後のシリーズで詳しく触れたいと思います。
トラックバック
このエントリーのトラックバックURL:
http://www.seibutsushi.net/blog/2012/06/1305.html/trackback
