前回の記事 [1]で、インフルエンザウィルスの概要が述べられています。
今日は、そのうちA型インフルエンザウィルスの分類上ポイント(H1N1Nなど)となっているHA(赤血球凝集素=ヘマグルチニン)と、NA(ノイラミニダーゼ)にスポット当てて、ウィルス感染の仕組みをなるべく簡単に概説したいと思います。
●HA=ヘマグルチニンは「くっつく」機能
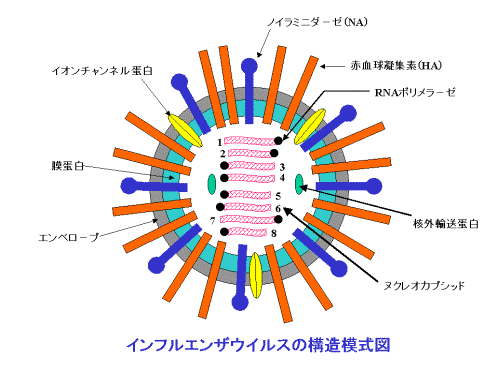
もう、おなじみと思いますが、A型インフルエンザウィルスは上図のような形をしています。
上図の「赤血球凝集素(HA)」に注目してください。
こいつは、インフルエンザが宿主細胞に「くっつく」ために使います(増殖の際にも関与しているようですがここでは省略します)。
ウィルスは、宿主細胞にとりついて、細胞内に進入しなければ増えられません。ですから、この「くっつく」機能というのは、インフルエンザウィルスにとっては、決定的に重要な機能です。
●HA=ヘマグルチニンがくっつくための条件
で、このHAは細胞のどこにでもくっつけるのか?というと、そうではありません。結合するための条件があります。その条件は大きく2つ・・・(ちょっと難しいですが)・・・。
1)とりつく細胞表面に糖タンパク質の糖鎖の「シアル酸残基」があること
2)シアル酸に結合している「ガラクトース」の結合様式(結合位置)が認識可能であること
この二つの条件が両方とも整わないとくっつけません。
インフルエンザウィルスがくっつくのは「シアル酸残基」ですが、ウィルスが「これはくっつけるものだ」と認識するためには「シアル酸とガラクトースの結合様式」が一定のものではないといけないわけです。
シアル酸とガラクトースの結合様式は専門的に「α2→6結合」や「α2→3結合」などと呼ばれているのですが、
・ヒト由来のインフルエンザウィルスは、「α2→6結合」しか認識できない。
・トリ由来のインフルエンザウィルスは、「α2→3結合」しか認識できない。
この違いが、鳥インフルエンザが人に感染しないと言われている理由です。
●ヒト・トリ・ブタ 各々のシアル酸とガラクトースの結合様式
人の気道上皮細胞(喉の粘膜)には、「α2→6結合」したガラクトースとシアル酸が多く分布しています。したがって、ここがまず第一の感染地帯になります。
鳥の場合は、場所が違って、大腸上皮細胞に「α2→3結合」したガラクトースとシアル酸が多く分布しているので、ここが感染地帯になります。
しかし、ブタは気道上皮細胞に「α2→6結合」と「α2→3結合」の両方を持っています。したがって、ヒト型、トリ型両方のインフルエンザに感染するというわけです。
また、人間でも一部に気道上皮細胞に「α2→3結合」(←鳥インフルエンザが認識出来る結合様式)を持つ人がいます。
その人の喉の粘膜には、鳥インフルエンザウィルスがくっつけますから、不幸にも鳥インフルエンザウィルスに感染しやすい体質となってしまいます。香港などで鳥インフルエンザの感染例が報告されたのは、そのような人たち(=限定的)であると見られています。
●「くっつく」→侵入→ウィルスの増殖
複雑で専門的なので、省きます。詳しくは、ウィキ [2]を参照ください。
インフルエンザウィルスは、なかなか巧みなことをやっているようです。
●ウィルスは細胞の外に出る・・・あれ?出れないぞ!
細胞内(宿主)に進入したウィルスは、その中で増殖します。しかし、宿主の外に出なければ意味がありません。当然、外に出ようとします。
このとき、細胞にくっつくときに使ったHA=ヘマグルチニンが悪さをします。宿主の細胞膜から外に出ようとした瞬間、自分がもっているHAが宿主の細胞表面のシアル酸残基とくっついてしまうのです。
インフルエンザウィルスにとっては、「くっつく」という可能性をもたらしたHAが、拡散過程の一等最初でアダとなってしまった格好です。これでは、細胞表面から離れられません。
●NA=ノイラミニダーゼでくっついたHAを「切る」
大変困ったことになりましたが、インフルエンザウィルスはそのための対策をちゃんと備えています。それがNA=ノイラミニダーゼです。
NAは、不用意にくっついてしまった自分側のHAと、宿主細胞表面のシアル酸残基を切り離す役割をします。
イメージ的には、くっついて離れなくなっている部分をハサミでチョッキンと切るヤツがNAだと思えばいいでしょう。結果、インフルエンザウィルスは、細胞表面から離れて別の細胞にくっつく=感染する旅に出て行きます。
●NAの「切る」役割を阻害する薬=タミフル
タミフル(オセルタミビル)は、NAの役割である「切る」ことを阻害する薬です。正確には、ノイラミニダーゼ阻害薬と呼ばれます。
タミフルに含まれるオセルタミビルリン酸塩という物質がインフルエンザウィルスのNA(ノイラミニダーゼ)と結合した結果、「切る」機能が阻害されます。結果として、インフルエンザウィルスは宿主細胞から離れられなくなり、拡散・増殖できないという具合です。
離れられなくてモジモジしている間に、免疫系が新しい抗体をつくるなどしてインフルエンザを撃退し、完治に至ります。
したがって、タミフルはインフルエンザウィルスそのものを破壊するような薬ではないとわかるでしょう。特効薬というより、かなり消極的で免疫依存の時間稼ぎ戦法といったところです。
感染後48時間以上断つと効かないといわれているのは、その時点ではウィルスが増殖しすぎて、全てのウィルスのNAと結合することが出来ない(多くのウィルスを取り逃がす)ためと思われます。
発病以前に服用すると予防的に効くといわれているのは、潜伏中のウィルスのNAを予め無効化しておくことを以ってそのようにいわれているようです。(理論的には可能ですが実態はどうか?)
●亜型=HAとNAの変異が意味するもの
通常のインフルエンザウィルスのHAは、同一の結合様式しか認識できないといわれています。
しかし、もしも、HAが変異して色々な結合様式(α2→6結合以外の結合様式)を認識できるようになったら・・・?もしくは、NAが変異して、いかなるときでも「切る」ことができるようになったら・・・?
それらが、恐れられている新型インフルエンザにつながっていきます。
「α2→6結合」(ヒト)と「α2→3結合」(トリ)の両方にくっつくHA認識機能を持ったインフルエンザウィルスで、感染箇所が広く、増殖性の強いもののが、今恐れられている新型インフルエンザです。
そのために、政府はタミフルをたくさん備蓄していますが、既にタミフル耐性、すなわち、オセルタミビルリン酸塩と結合しないNAを持ったインフルエンザウィルスが登場しています。
・・・と、長くなってしまいましたが、いかがだったでしょうか。
あと一話ありますので、ご期待ください。