原核生物の細胞骨格の話題が続いていますので、今回はアクチンとチューブリンの基本をおさらいします。
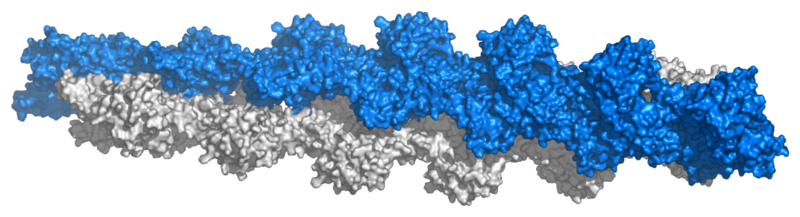 アクチンフィラメント(ウィキペディアより)
アクチンフィラメント(ウィキペディアより)
アクチンと言えば筋収縮を思い浮かべる方も多いと思います。ミオシンがアクチンを引っ張ることで筋細胞を収縮させる運動です。
もともと筋細胞で発見されたので「act+in」=アクチンと名づけられたようです。
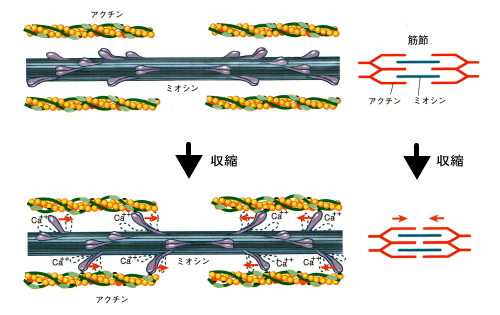
筋収縮の図
しかし、アクチンの働きはそれだけではありません。
アクチンは全ての真核細胞に存在。その多くでもっとも大量に存在:全タンパク質の5%、脊椎動物の骨格筋細胞では全重量の20%。
高度に保存されたタンパク質;酵母では1種類だが、哺乳類では少なくとも6種類、α-actin(筋肉)、β,γ-actin(非筋肉細胞)。ATPが強く結合。
京都大学大学院生命科学研究科統合生命科学専攻細胞全能性発現学講座 [4]
原核細胞にもアクチン様、チューブリン様タンパク質が多く見つかっています。
そこでアクチンの特徴をチューブリンと比較しながら(主に共通点を)列挙すると、
・多量体を形成し細胞骨格として働くことは両者に共通する構造です。
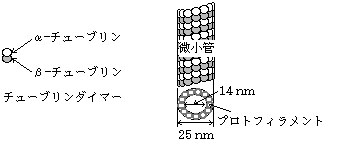
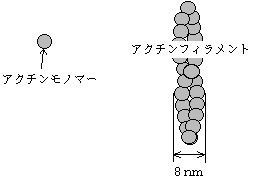
・アクチンは単量体を重合して(一種類のたんぱく質を連ねて)高分子化するのに対し、チューブリンはα-チューブリンとβ-チューブリンが1個ずつ結合した”チューブリンダイマー”が直線上に重合し、微小管のプロトフィラメントを構成する。
画像は都城工業高等専門学校物質工学科徳楽研 [5]から拝借しました。
・両者とも極性を持ちプラス側へ伸長する。(アクチンはマイナス側にも伸びるがプラス側への伸び率が大きい)。チューブリンがアクチンより極性が強い。
・重合核形成:チューブリンには中心体があるが、アクチンにも重合核があるようだ。アクチンの重合核形成は細胞膜で起こることが多い。
・モータータンパク:チューブリンはキネシンとダイニン、アクチンはミオシンというモータータンパクと組み合わされることで、原形質流動や細胞小器官の移動、鞭毛運動などの活動を行い、細胞分裂の際には重要な役割を担っている。
・結合型:アクチン分子 ATP結合型が遊離状態、重合しやすい。ADP結合型が重合状態、解離しやすい。
チューブリン分子はGTP結合型が重合しやすく、GDP結合型が解離しやすい。(と書きましたが違いは理解していません。)
さて、いくつか列挙しましたが、私の問題意識はアクチンとチューブリンには本質的な違いはないのではないかということです。原核生物の細胞骨格を研究する学者たちがアクチン派とチューブリン派に分かれて仮設を提起しているに過ぎず、原核生物のらせん構造を持つ細胞骨格もFtsZ、MreBなど明確に区別されていないように思えます。
チューブリンはα(マイナス)とβ(プラス)の異なる極性を有する二つのタンパク質を組み合わせることで電位差を強め、さらに電池を直列につないでいくように微小管を作ることで電位差を大きくし、加えて大きな直径で重量も大きくすることで、引っ張る力を強くしたと考えられます。したがって真核生物の染色体のように巨大な分子を引っ張るには、大きな力を有するチューブリンが必要になったのではないでしょうか。